點擊標題下方"高中化學」關注我們,即可獲取教育經驗、方法、學習資料等,每天與您相約!
高中化學
每天給你想要的
關注不錯過
化學姐
高中化學學習中會遇到實驗操作類型的題,今天化學姐要給大家講的就是有關結晶問題。
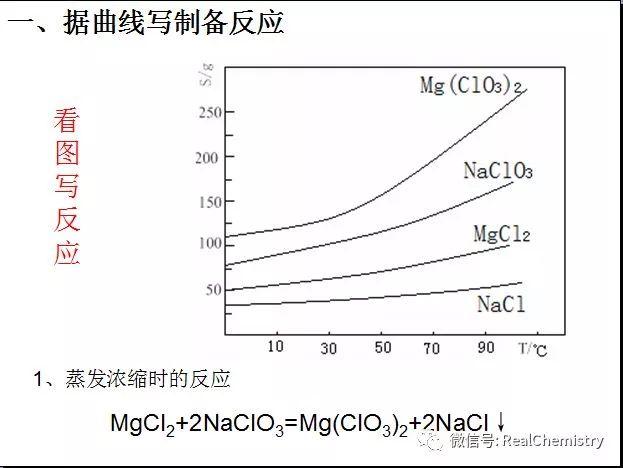 ...
... 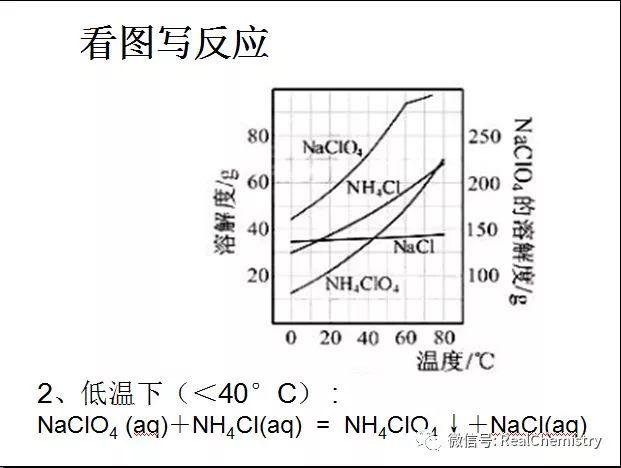 ...
... 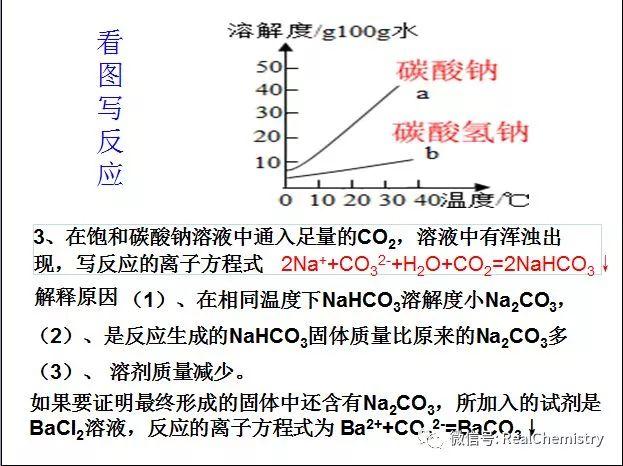 ...
...
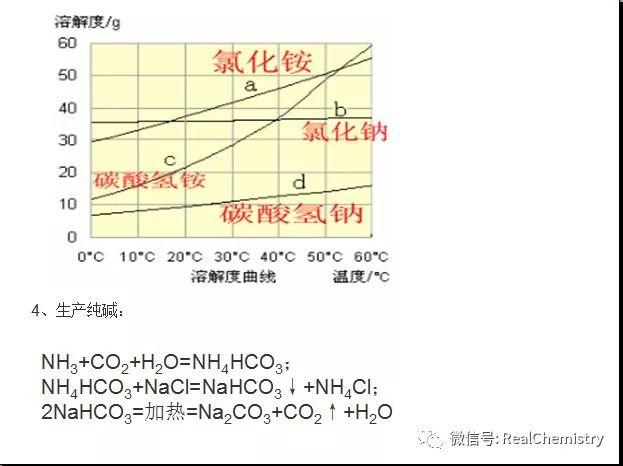 ...
...
 ...
... 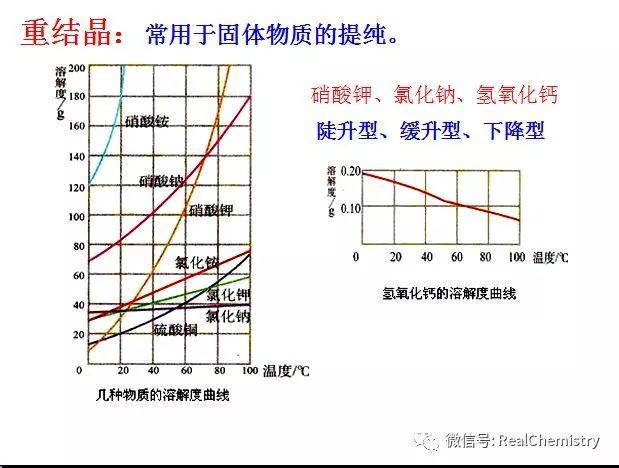 ...
... 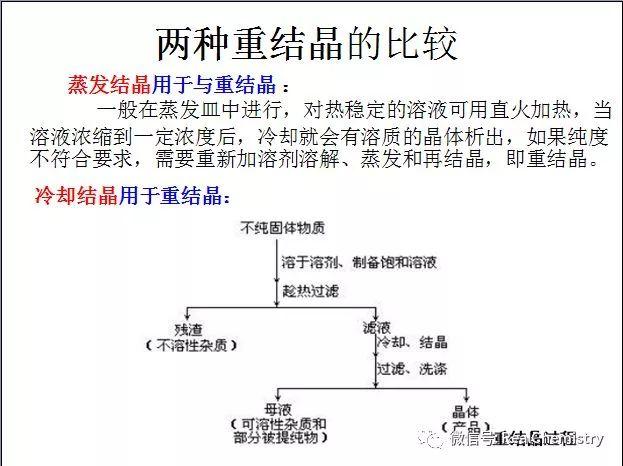 ...
... 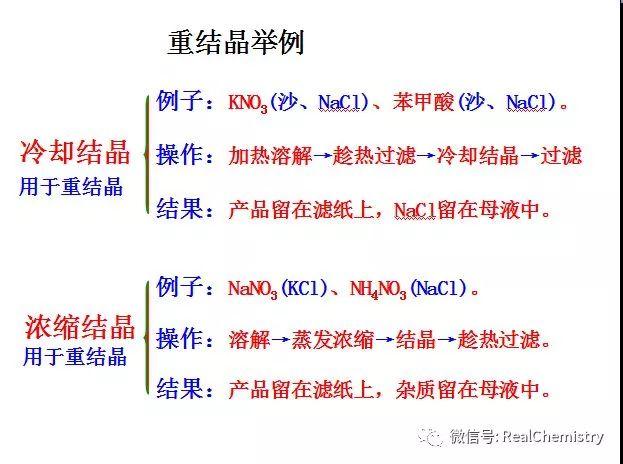 ...
...
化學實驗中的晶體洗滌大有講究
化學高考試題中,經常涉及對所得晶體或固體殘渣進行洗滌,洗滌大有講究,要考慮幾個方面,如:為什麼要洗滌?用什麼洗滌?怎樣洗滌?怎樣證明已經洗滌乾淨?等等。
一、關於洗滌的目的
關於晶體或殘渣為什麼要洗滌,即洗滌的目的,常見有:①除去雜質:除去晶體表面的可溶性雜質。②提高產率:洗滌過濾所得到的殘渣,把有用的物質,如目標產物儘可能洗出來。③防止污染環境:如果濾渣表面有一些對環境有害的物質,如重金屬離子或CN -,為了防止污染環境,往往對殘渣進行洗滌。
例1(北京卷改編)以富含硫酸亞鐵的工業廢液為原料生產氧化鐵的工藝如下(部分操作和條件略):
I從廢液中提純並結晶處FeSO 4·7H 2O;II將FeSO 4溶液與稍過量的NH 4HCO 3溶液混合,得到含FeCO 3的濁液;Ⅲ將濁液過濾;Ⅳ用90℃熱水洗滌沉澱,乾燥後得到FeCO 3固體;V煅燒FeCO 3,得到Fe 2O 3固體。已知:NH 4HCO 3在熱水中分解。
問題:IV中為什麼要用熱水洗滌?
解析:FeSO 4溶液與稍過量的NH 4HCO 3溶液混合,在得到FeCO 3的濁液里含有雜質離子SO 4 2-和過量的NH 4HCO 3化學論文化工論文,由於NH 4HCO 3在熱水中會分解,這樣就除去了NH 4HCO 3,另外也可除去SO 4 2-。所以,答案為:可以除去可溶性的雜質SO 4 2-和NH 4HCO 3。
例2(江蘇卷):鋇鹽行業生產中排出大量的鋇泥[主要含有BaCO 3、BaSiO 3、BaSO 3、Ba(FeO 2) 2]等。某主要生產BaCl 2、、BaCO 3、BaSO 4的化工廠利用鋇泥製取Ba(NO 3) 2,其部分工藝流程如下:
問題:上述流程中洗滌的目的是 。
解析:鋇泥加入稀硝酸後BaCO 3、BaSiO 3變為Ba 2+、CO 2氣體、H 4SiO 4(或H 2SiO 3)沉澱,BaSO 3轉化為BaSO 4,Ba(FeO 2) 2轉化為Ba 2+和Fe 3+,加入沉澱如BaCO 3,可控制溶液的PH=4~5,把Fe 3+轉化為Fe(OH) 3沉澱,接著加入Ba(OH) 2可把少量的HNO 3轉化為Ba(NO 3) 2,這裡洗滌的目的是把濾渣表面的硝酸鋇除去,防止污染環境,這是標準答案。筆者認為把洗滌液又加入到初始的溶液中,相當於殘液又被利用,提高了原料鋇泥的利用率。所以,最佳答案為:減少廢渣中可溶性鋇鹽對環境的污染;提高原料鋇泥的利用率。
二、關於洗滌的試劑
對於用什麼洗滌,我們經常可以用以下幾種:①蒸餾水;②冷水;③有機溶劑,如酒精、丙酮等;④該物質的飽和溶液。一般經常用的洗滌劑是蒸餾水,如果用其他的洗滌劑,必有其「獨特」之處。用冷水可適當降低晶體因為溶解而造成損失。用酒精等有機溶劑洗滌的好處常見有:可以降低晶體因溶解而造成損失,可以除去表面的可溶性雜質和水分;酒精易揮發,晶體易乾燥。注意:有特殊的物質其溶解度隨溫度升高而下降的,可以採用熱蒸餾水洗滌。用該物質的飽和溶液可以使因為溶解造成的損失降到最低。
例1(江蘇卷):硫酸亞鐵(FeSO4·7H2O)是一種重要的食品和飼料添加劑。實驗室通過下列實驗由廢鐵屑製備FeSO4·7H2O晶體:
①將5%Na2CO3溶液加入到盛有一定量廢鐵屑的燒杯中,加熱數分鐘,用傾析法除去Na2CO3溶液,然後將廢鐵屑用水洗滌2~3遍;
②向洗滌過的廢鐵屑加入過量的稀硫酸,控制溫度50~80℃之間至鐵屑耗盡;
③趁熱過濾,將濾液轉入到密閉容器中,靜置、冷卻結晶;
④待結晶完畢後,濾出晶體化學論文化工論文,用少量冰水2~3次,再用濾紙將晶體吸干;
⑤將製得的FeSO 4·7H 2O晶體放在一個小廣口瓶中,密閉保存。
問題:實驗步驟④中用少量冰水洗滌晶體,其目的是;。
解析:冰水作為洗滌劑,應該從兩方面來說明。首先它是水,可以將某些可溶性的雜質溶解而除去;其次,要說明作為冰水溫度低有什麼好處。參考答案為:洗滌除去晶體表面附著的硫酸等雜質;用冰水洗滌可降低洗滌過程中FeSO 4·7H 2O的損耗。
例2(蘇州調研)某實驗小組在實驗室按下列流程進行製取摩爾鹽[(NH 4) 2SO 4·FeSO 4·6H 2O]的實驗:
問題:反應Ⅱ後的溶液經蒸發等操作所得固體用乙醇洗滌的目的是。
解析:由於莫爾鹽屬於無機鹽,在水中的溶解度大於在乙醇中,用乙醇洗滌可以降低莫爾鹽因為溶解而造成損失;其次,由於水易溶於乙醇,用乙醇可以除去水,並把可晶體表面的雜質「沖走」;另外,酒精易揮發,很容易使晶體保持乾燥。參考答案為:可降低莫爾鹽因為溶解而造成損失;可除去表面的水分和一些雜質;酒精易揮發,晶體容易乾燥。
三、關於洗滌的方法
洗滌的正確方法是:讓過濾後的晶體繼續留在過濾器中,加洗滌劑浸沒過晶體,讓洗滌劑自然流下,重複2-3次即可。注意點:在洗滌過程中不能攪拌,因為濾紙已經很潤濕,如果攪拌就很容易攪破濾紙,這樣晶體會淋失,從而造成晶體損失。
例題(江蘇卷):下列有關實驗原理或操作正確的是
A.選擇合適的試劑,用圖1所示裝置可分別製取少量CO 2、NO和O 2B.製備乙酸乙酯時,向乙醇中緩慢加入濃硫酸和冰醋酸
C.洗滌沉澱時(見圖2),向漏斗中加適量水,攪拌並濾干
D.用廣泛PH試紙測得0.10mol·L -1NH 4Cl溶液的PH=5.2
解析:此題易選C,其實C是錯誤的,因為洗滌沉澱時是不能攪拌的。A中NO不能用排空氣法收集,A錯;D中廣泛PH試紙只能測到整數,D錯;正確答案為B。
四、關於洗凈的標誌
對於洗滌乾淨的標誌,可以採用物理方法,也可以化學方法。如果可溶性的雜質的水溶液有顏色,可以直接通過觀看最後一次洗滌液是否有顏色化學論文化工論文,如果顯無色,說明已洗滌乾淨,反之沒有洗滌乾淨;對於含Na +、K +的可溶性雜質可以通過焰色反應來鑑別,從而判斷有無洗滌乾淨;對於用物理方法無法判斷的,可以通過化學方法來判斷。方法是:取最後一次洗滌液來做實驗。
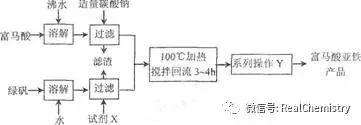
例1(南京一模):富馬酸亞鐵(分子式C 4H 2O 4Fe,結構簡式是一種可限量使用的鐵強化劑。下圖為實驗室模擬工業製取富馬酸亞鐵的流程圖:
 ...
...
問題:操作Y包括蒸發濃縮、冷卻結晶、過濾、洗滌、乾燥等。判斷該操作中「洗滌」富馬酸亞鐵產品已洗凈的實驗方法是______。
解析:富馬酸亞鐵表面的可溶性雜質離子有Na +、SO 4 2-等,可以從檢驗洗滌液中是否含Na +或SO 4 2-來設計實驗。參考答案為:取最後一次洗滌液,先加入稀鹽酸,再加入氯化鋇溶液,無白色沉澱生成,說明已洗滌乾淨。
總之,對實驗過程中的一些操作如洗滌,多思考幾個為什麼,知其然,更要知其所以然,這樣實驗技能就會發生質的飛躍 。
Tips:
好文推薦
精彩回顧:
1、【致敬高考】沒有傘的孩子,只能努力奔跑!
2、乾貨丨高中有機物常見除雜方法一覽,拿走不謝!
3、考前20多天,怎樣快速搶分?四步教你快速突破高考化學推斷題!
4、文綜270+,理綜290+,高考學霸們的經驗分享!答題有套路!
5、乾貨丨粒子間作用力與晶體17條重要知識,純乾貨,要收藏!
 ...
...